Plettfrie standarder: mestring av kontamineringskontroll i personlig pleie og kosmetikk
Basert på en artikkel opprinnelig publisert i 2025. juni-utgaven av Personal Care Magazine.

Etabler en gjentakbar og tydelig prosedyre for å sikre at dere består vurdering av visuelt ren på tvers av ulike operatører.
Tenk deg at en liten feil i rengjøringsprosedyren ikke var bra for omdømmet til merkevaren på bare noen få dager. Fra det som syntes å være et enkelt feiltrinn i prosedyren for rengjøring og desinfisering (C & S), står du nå overfor en produkttilbakekalling og pressemelding for å advare forbrukerne, en formell rotårsaksanalyse og en korrigerende handlingsplan, blant mange andre ansvarsområder. De økonomiske kostnadene og omdømmekostnadene er svimlende, med potensielle FDA funn som legger til byrden. Dere har nå dedikert timer, dager, og til og med uker til å rette opp et problem som lett kunne ha vært forhindret med riktige C&S-kontroller. I kosmetikkverdenen handler det å sikre plettfritt utstyr ikke bare om overholdelse – det handler om å sikre forbrukernes tillit og helse.
For det meste krever forskrifter verden over at produkter for personlig pleie og kosmetikk ikke blir urene eller forurenses. Produsenten må oppfylle disse forskriftene ved å kontrollere kritiske trinn i produksjonsprosessen for å sikre at kontaminering ikke oppstår. Ulike kontroller kan innføres i produksjons- og emballeringsprosesser, rengjøringsprosesser, medarbeiderhygiene, anleggshygiene, råvarekontroller og opplæring av medarbeidere, for å nevne noen. Utgivelsen av utkastet til Current Good Manufacturing Practices (cGMPs) av Modernization of Cosmetics Regulation Act (MoCRA) venter fortsatt, og med det kommer spekulasjoner om hva som vil eller ikke vil være nødvendig. Den internasjonale standarden for GMP for kosmetikk, ISO 22716:2007, kan refereres til som en indikasjon på potensielle retningslinjer som kan påvirke utkastspråket til MoCRA GMP. For eksempel krever ISO 22716:2007 - 4.10.3 & 4.10.4 spesifikke rengjøring og/eller desinfisering agenter som er verifisert i effektivitet og velges og brukes i henhold til de spesifikke behovene til hvert anleggsområde. Med andre ord, forskjellige områder av anlegget deres kan kreve forskjellige rengjørings-SOP-er, og hver SOP må verifiseres med tanle på effektivitet. Som et annet eksempel skisserer ISO 22716:2007 - 7.2 viktigheten av dokumentasjon, sporbarhet, kvalitetskontroller og batchadministrasjon, blant andre krav. Dette beskriver presset for at industrien skal bevege seg mot "First tid Right" (FTR)-ideologier, som sikrer at driften er revisjonsklar og produktene produseres og leveres i henhold til spesifikasjoner.
Til syvende og sist bidrar disse cGMP-retningslinjene til å redusere forurensningsrisiko og gi selskaper tilit til at de leverer trygge kvalitetsprodukter til forbrukerne. Det må anerkjennes at enhver ny GMP kan være skremmende i starten. Tatt i betraktning at C&S er en nøkkelkomponent i GMP-er, kommer denne artikkelen til å ta deg gjennom risikoene og den beste praksisen forbundet med rengjøringsprosedyrer for kritisk prosessutstyr.
Kostnaden for urent utstyr
I den digitale verdenen vi lever i kan merkevaren til et selskap bli negativt påvirktet i løpet av få dager via sosiale medier når såkalte feil med produktet blit publisert. På samme måte kan rapporter om funn fra revisjoner eller tilbakekallinger skade omdømmet til merkevaren. Disse feilene eller revisjonsfunnene kan ha mange årsaker, deriblant rester som er overført fra forrige produksjon på grunn av utilstrekkelig rengjøring eller smaker og viskositetsendringer på grunn av mikrobiologisk kontaminering. Til syvende og sist rengjør produsentene for å minimere risikoen for produktkontaminering. Typer kontaminering inkluderer krysskontaminering av produkter, aktiv krysskontaminering, mikrobiell kontaminering, eller også kontaminering fra rengjøringsprodukter. På grunn av disse risikoene er det avgjørende å forstå standardene for renhet som kreves for å sikre produktsikkerhet og kvalitet. Dette gjør at vi sstiller oss spørsmålet: "Hvor rent er rent nok?"
Hvor rent er rent nok?
Hvor mye som skal rengjøres for å unngå kontaminering virker subjektivt og åpent for tolkning. Hvis man skal diskutere, tenk over at at rengjøringsnivåer kan evalueres i tre grader av renslighet – visuelt ren, rent for rester eller mikrobielt rent. Selv om disse kategoriene av renslighet er relatert til hverandre er hver av dem knyttet til ulike nivåer av risiko for forbrukerne. Tilsynsorganer som har ansvar for å sikre forbrukersikkerhet, har gitt en viss veiledning. De følgende avsnittene viser hvert nivå, tilknyttede risikoer og potensielle løsninger.
1. Visuelt ren
ISO gir en rengjøringsstandard for bransjen som snakker om «visuell renslighet» i ISO 22716–2007: Cosmetics-Good Manufacturing Practices (GMP)2, der rengjøring beskrives som «å identifisere og eliminere generelt synlig smuss fra en overflate» (seksjon 2.8). Denne standarden angir at at synlig smuss skal fjernes fra en utstyrsoverflate.
Av alle typer forurensning virker det som at denne standarden er den enkleste å oppnå, men i praksis er dette ikke alltid tilfellet. Det kan være tvetydighet i å definere "basistilstanden" eller utgangspunktet. For eksempel, hva om tanken er farget, markert med rødt, eller på en eller annen måte blitt skadet, slik at ingen husker den vakre sølvglansen på det nye rustfrie stålet? Hvordan ville man ha etablert en visuelt ren standard? Tankutbedring eller passivering kan utføres i en situasjon som denne for å returnere utstyret til en "basetilstand" eller et lignende, nytt utseende. Alternativt, gjennom testing (av rester,og mikrobielle tester) og risikovurdering, kan en kvalitetsgruppe og produksjonsgruppe justere på en best case nåværende tilstand og en ny grunnlinje.
Så hvordan måler man visuelt rent? Visuelt rent er en testmetode som krever en prosedyre, standardisering og kanskje kalibrering. La oss utforske tre nøkkelvariabler som bidrar til å definere hva som anses som visuelt rent: lysforhold, overflateforhold og måleinstrumentet.
Belysning, eller mangel på lys, kan påvirke evnen til å se overflaten tydelig. Dermed må en C&S-inspeksjonsprosedyre inneholde en belysningsdefinisjon som spesifiserer lyskilden, pæretype, belysningsvinkel og så videre. Vedlikehold av lyskilden kan også være nødvendig, da tilstanden til lyspæren kan forverres over tid. Enkelte ganger kan det være nødvendig med en forebyggende vedlikeholdsplan for lyskilden.
Tilstanden til overflaten som inspiseres er også avgjørende. For eksempel kan en våt overflate se annerledes ut enn en tørr overflate, og kan skjule at det er rester av jord. Dermed må prosedyren spesifisere overflatetilstanden, dvs. om overflaten er våt eller tørr for inspeksjon.
Operatøren er det primære "instrumentet" eller testenheten i en visuelt ren vurdering. En operatør må være vurdert eller kvalifisert som i stand til å utføre testen. Synsskarphet, korrigerende linser og evnen til å skille farger kan være avgjørende for å kvalifisere en tekniker for en visuelt ren vurdering. Når kapasiteten er etablert, bør teknikeren få opplæring i riktig inspeksjonsteknikk etter den skriftlige prosedyren.
Når kravene til prosedyren er definert, så må kriteriene for hvor vellykket testen er etableres. Siden ingen numeriske testresultater er knyttet til visuell vurdering, er en visuell standard nødvendig for å sikre konsekvent måling mot kriteriene for suksess. Dette oppnås ofte gjennom en visuell standard opprettet med bilder av akseptable versus ikke-akseptable visninger. Resultatene bør dokumenteres etter hvert rengjøring. Disse visuelle standardene bidrar til å redusere risikoen som følger med det å ha flere kvalifiserte operatører til å utføre den visuelle testen. Selv om papirbaserte og digitale formater er akseptable for å huse disse prosedyrene, er det mange fordeler med å bruke et digitalt format: Disse fordelene inkluderer, men er ikke begrenset til, en mer interaktiv og engasjerende opplæringsopplevelse for operatørene og en mer robust dokumentasjon og historisk datasporbarhet for revisjon av beredskap.
2. Residually Clean
Selv om utstyret rengjøres til en «visuelt ren» standard, kan rester på nivåer som ikke er synlige, påvirke forbrukersikkerheten. For eksempel er enkelte aktive stoffer, som kjemiske ingredienser i solkrem, ikke synlige. Vaskemidler kan også etterlate rester som påvirker produktkvaliteten hvis de ikke skylles tilstrekkelig, noe som kanskje ikke kan oppdages ved visuell inspeksjon.
Å fjerne alle påviselige nivåer av produkt, aktive stoffer og vaskemiddel for å sikre en ren overflate er ikke økonomisk for produsentene, da det kan være nødvendig med for mye tid og vann. Avhengig av bransjen kan reguleringsorganer ta en risikobasert tilnærming, noe som krever at rester reduseres til et "sikkert nivå" for kundebruk. Ofte er dette "sikre nivået" basert på en toksikologisk vurdering, som sikrer at restmengden som føres inn i neste parti er godt under et observerbar effekt nivå av bivirkninger. Dette krever at produsentene kjenner til restene som kan finnes, et trygt og akseptabelt nivå av rester, en testmetode for å verifisere restnivået og en rengjøring prosess som på en pålitelig måte fjerner produktet, aktive stoffer og oppvaskmiddel som er trygt. En kosmetisk produsent kjenner formuleringen sine, og kjenner derfor til de aktive stoffene eller formulerte ingrediensene som kan bli igjen som rester, og dermed også hvor aktive og giftige de er. De har vanligvis en testmetode som allerede er utviklet for den aktive ingrediensen, da de sannsynligvis tester den endelige formuleringen for å verifisere at den er innenfor spesifikasjonen. Denne testmetoden må kanskje verifiseres eller modifiseres for å måle de laveste nivået av rester av de aktive stoffene etter grundig rengjøring. Ofte kan en ikke-spesifikk test som testmetoden Total Organic Carbon (TOC) verifisere at ikke-aktive formuleringsingredienser er fjernet.
Det som kan være ukjent for kosmetikkprodusenter, kan være rengjøringsvaskemiddelet. En anerkjent leverandør vil kunne dele informasjon om giftighet for vaskemiddelet og passende testmetoder for å bestemme eventuelle rester. Innenfor bransjen kan testmetodene være spesifikke (identifisere den bestemte kjemiske komponenten) eller ikke-spesifikke (som indikerer tilstedeværelsen av en rest, men ikke det bestemte kjemikaliet), basert på en toksisitetsrisikovurdering. Ofte er vaskemidler som brukes innen kosmetikk lav risiko og kan testes med ikke-spesifikke metoder. Eksempler inkluderer en total organisk karbonledningsevne (TOC), pH, osv. I noen av disse tilfellene er laboratoriearbeid nødvendig for å gi en korrelasjon eller oversettelse fra det ikke-spesifikke metoderesultatet til det faktiske restnivået. Produsenten av vaskemidler skal kunne bistå i denne utviklingen.
Selv om det å oppnå restrenhet er avgjørende for å eliminere skjulte kontaminanter, er det like viktig å ta tak i de mikrobielle truslene som kan kompromittere produktsikkerheten. Dette tar oss til det siste nivået av renhet: å sikre at utstyret er rent for mikrober.
3. Rent for mikrober
Mikrobiell forurensning forårsaket av biobyrde i utstyret blir en større bekymring og interesse i kosmetikkindustrien. Vi må utdype begreper før vi undersøker alternativer for å få kontroll over mikrobiell kontaminering. To begreper som forvirrer er sanering og desinfeksjon. I EPA - og USP-standarder er reduksjon av mikrobiell belastning referert til som rensing, mens desinfeksjon er definert som å ødelegge eller irreversibelt inaktivere mikroorganismer. I denne artikkelen bruker vi begrepet sanitering i betydning av å redusere mikrobiell belastning ned til ønskede nivåer, uavhengig av applikasjonens geografiske plassering.
Når nivået av renhet og rester er oppfylt, er det fortsatt potensial for mikrobielle rester på utstyr som kan kontaminere et kosmetisk produkt. Hvis mikrobiell kontaminering er ekstremt, som i et slimete, misfarget område som indikerer tilstedeværelse av biofilm, kan en visuell inspeksjon avdekke problemet. Ofte oppdages mikrobiell kontaminering kun gjennom testing av ferdig produkt, med høye mikrotall som resulterer i at partier blir avvist. Selv om historien ikke nødvendigvis avdekker problemer med mikrobiell kontaminering for produkter som er produsert i et anlegg, viser de nyeste produkttrendene at man heller mot mer naturlige ingredienser – noe som kan øke potensialet for å introdusere tidligere usette mikrobielle flora. I tillegg minsker konserveringsalternativene ettersom EU fjerner konserveringsmidler for bruk i kosmetiske produkter– noe som betyr mindre forsikring innen formuleringer for å motvirke mikrobiell vekst og forurensning.

Uten riktige prosedyrer for rengjøring og desinfisering er utstyret ditt i fare for mikrobiell vekst, noe som kan vises som biofilm på interiøret til utstyret.
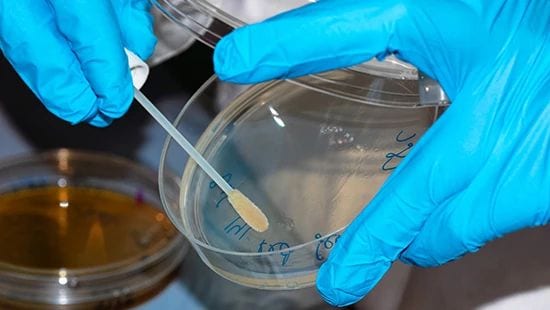
Mikroswabbing er en vanlig metode for å teste mikrobielle rester.
Mikrobielle rester kan måles med enten mikroprøver eller prøver av skyllevann, avhengig av utstyrets design og tilstand. Det er unike utfordringer med testing av mikrobielle rester, primært knyttet til tilgang til prøvepunkter. Ofte er områdene i utstyret med høyest risiko for mikrovekst de områdene som ikke er lett tilgjengelige, som for eksempel rør, skjøter på utstyr eller, i noen tilfeller, overflater på utstyr som er skadet av furing eller groptæring. Disse områdene som er vanskelige å få tilgang til for prøvetaking, er også de vanskeligste å desinfisere effektivt, noe som øker risikoen.
Den primære metoden for å kontrollere mikrobielle rester på rengjort utstyr er gjennom et desinfiseringstrinn. Produsenter av personlig pleie og kosmetikk har historisk brukt termisk desinfisering for å redusere mikrobielle rester. Formuleringstrendene nevnt ovenfor øker viktigheten av å opprettholde god mikrobiell kontroll i produksjonsutstyret. Ytterligere press for å kontrollere kostnadene og redusere energiforbruket fører til at selskaper går over fra ofte brukt varmtvannsdesinfisering til kjemisk desinfisering. Tilliten til at den termiske prosessen er effektiv, og fungerer i validert tilstand, avhenger i stor grad av temperatur og tid for alle kontaktpunkter til utstyret. Kjemisk desinfisering blir stadig mer populært med sikret mikrobiologisk effektivitet validert ved hjelp av et spesifikt produkt, konsentrasjon og kontakttid – ofte ved omgivelsestemperaturer og i kun noen få minutter.
Oppsummert
Å sikre at produkter for personlig pleie og kosmetikk produseres i et miljø uten forurensning er avgjørende for forbrukerens helse og sikkerhet. Et viktig skritt produsenten kan ta, er å utvikle et rengjørings- og desinfiseringsprogram som effektivt fjerner kontaminering fra produksjonen. Disse kontaminantene kan være rester fra produkter (aktive eller ikke), vaskemidler eller mikrobiell belastning. Rengjøring til en "visuelt ren" standard er viktig, og er ikke noe som kan forhandles. Utvikling av standarden, prosessen, akseptgrenser og opplæring er avgjørende.
Vi har utforsket det faktum at det å oppnå "visuelt rent" kanskje ikke er nok. Usynlige rester, slik som rester av vaskemidler, rengjøringsmidler eller mikrobiobyrde, kan bidra til kontaminering som påvirker produktkvaliteten. Rengjørings- og desinfiseringsprogrammer må ta tak i alle disse typene rester nøye for å sikre at produktkvaliteten ikke påvirkes.
For å sikre at produktene dine oppfyller de høyeste standardene for renhet og sikkerhet bør du vurdere å samarbeide med eksperter som spesialiserer seg på kontamineringskontroll. Dette kan beskytte merkevarens omdømme, beskytte forbrukernes helse og ligge i forkant av regulatoriske krav. Ikke vent på et problem med kontaminering – ta proaktive skritt nå for å implementere et robust program for rengjøring og desinfisering.

Overvinne utfordringer på produksjonsgulvet
Ecolab kan optimalisere produksjonsprosessene dine for personlig pleie.
Oppnå betydelige besparelser av tid og utgifter.
Referanser
- Vedlegg 15 i EUs GMP-retningslinjer sier: «Grenser for overføring av produktrester skal baseres på en toksikologisk evaluering. Begrunnelsen for de valgte rammene bør dokumenteres i en risikovurdering som inkluderer alle støttehenvisningene.»
- Kilde: https://www.epa.gov/pesticide-registration/pesticide-registration-manual-chapter-4-additional-considerations
- Kilde: USP kapittel 1072



